Старение — это уменьшение с возрастом ожидаемой продолжительности жизни. Начиная с определённого возраста с каждым годом возрастает вероятность смерти человека. После 20 лет каждые восемь лет жизни увеличивают риск примерно в два раза. Люди умирают от болезней сердца, от рака, инсульта, эмфиземы, пневмонии, болезней почек, болезни Альцгеймера, от несчастных случаев. Но хорошая новость заключается в том, что научно-технический прогресс уже позволил победить многие заболевания и увеличить продолжительность жизни человека.
За последние 60 с лишним лет во всех странах возросла продолжительность жизни, причём в некоторых люди стали жить примерно на 20 лет дольше. В Австралии, Канаде, Японии, в некоторых европейских странах средняя продолжительность жизни превышает 80 лет. Это к вопросу о важности хорошей медицины в стране, разумного использования научных достижений, применения эффективных лекарств, а не какой-нибудь гомеопатии и так далее. Но в целом во всём мире заметен прогресс.
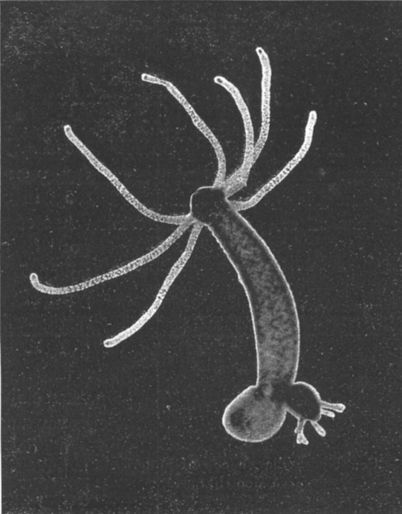
Ещё в конце XIX века была выдвинута гипотеза о теоретическом бессмертии гидры. В 1997 году Даниэль Мартинес доказал гипотезу экспериментальным путём
Когда возникает вопрос, можем ли мы победить этот растущий график увеличения смертности, то я вспоминаю слова братьев Райт: «Если птицы могут летать, то и мы можем достигнуть контролируемого полёта». Биологи говорят, что если у гидры с возрастом риск смерти не увеличивается, то, вероятно, этого можем добиться и мы. Нет никаких принципиальных ограничений, не позволяющих живому организму жить очень долго.
Классический пример долгоживущего организма — голый землекоп, который живёт в десять раз дольше своих родственников — мышей и крыс. Геном голого землекопа уже исследуют учёные в надежде понять, что делает это существо таким особенным и долгоживущим.
Если оценивать разнообразие жизни в масштабах планеты, то у млекопитающих продолжительность жизни может отличаться почти в сотню раз, а у животных в целом — в десятки тысяч раз. С чем это может быть связано? Очевидно, что важную роль в процессе старения и долгожительства играют гены. Какая-нибудь землеройка или полёвка с эволюционной точки зрения не особо заинтересована в том, чтобы жить долго. В природе мало кто из представителей этих видов доживает до преклонного возраста, их достаточно рано съедают хищники. Даже если бы появилась какая-то мутация, продлевающая жизнь, то от неё было бы мало толку с точки зрения увеличения репродуктивного успеха. А у видов, избавившихся от угрозы со стороны хищников, мы как раз наблюдаем увеличение продолжительности жизни. Тот же голый землекоп, обитающий под землёй, может прожить 31 год. Другой пример защиты от хищников — умение летать, как в случае с летучими мышами и птицами. Люди же могут защититься с помощью науки и технологий.
Есть организмы, в геном которых уже заложены программы смерти. Например, у некоторых видов лосося самки умирают сразу после нереста. Но есть более интересный пример — этот осьминог:
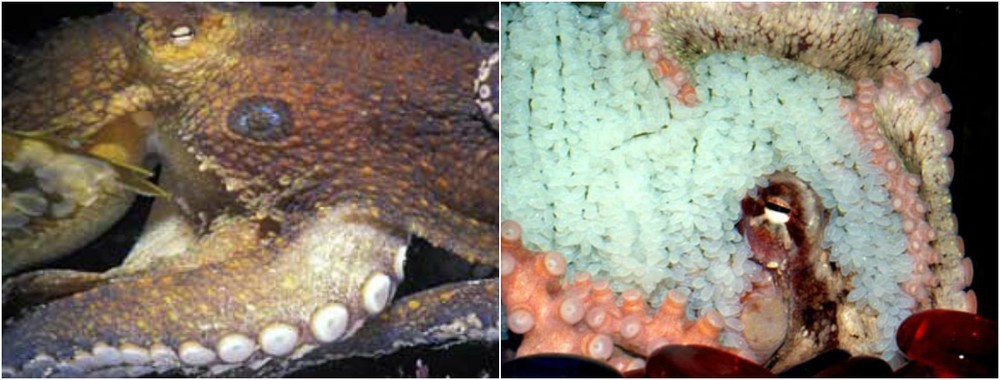
Иллюстрация: A SNAIL'S ODYSSEY
Самка осьминога откладывает яйца, перестаёт питаться и в среднем через месяц умирает. Это запрограммированная смерть. Но оказалось, что эту программу можно отменить, причём хирургически — просто вырезав пару желёз, после чего осьминог может прожить не месяц, а 6–9 месяцев.
Есть примеры запрограммированной клеточной смерти, когда отдельные клетки могут себя сами убивать. Этот процесс называется апоптоз: когда клетка накапливает большое количество мутаций, чтобы не стать раковой, не создавать угрозу организму, она себя уничтожает, причём достаточно разумно — клетка не просто выплёскивает всё своё содержимое наружу, а разваливается на компартменты, которые потом могут быть захвачены соседними клетками и утилизированы.
Интересно, что существует переход от смерти клеток к смерти целого организма. Кишка круглого червя Caenorhabditis elegans (нематод) немного флюоресцирует. И когда червь умирает в силу естественных причин или в результате некоторых повреждений, то за час до смерти в передней части кишки свечение усиливается и волной постепенно проходит до конца кишки. После этого червь отходит в мир иной. Это явление получило название «голубой волны смерти». Волну можно индуцировать искусственно, например заморозив и разморозив червя. Также учёные нашли способ, как эту волну остановить. Продолжительность жизни червя не увеличивается, но если его повредить, то он от этого не умирает. С возникновением волны запускается процесс клеточной смерти, но потом это синее свечение угасает, и червь продолжает жить дальше. Само свечение служит просто индикатором, а на самом деле это волна гибели клеток вдоль кишки, что и приводит к смерти.
Почему возник этот механизм? По-видимому, в результате такой «смерти через час» червь достаётся в качестве пищи своим собственным потомкам. Черви вынашивают деток, умирают и становятся пищей для следующего поколения. Символ жертвенного материнства.
У людей, по крайней мере у взрослых, подобных механизмов не обнаружено. У нас старение представляет собой совокупность многочисленных разнообразных процессов. Один из них — это старение клеток.
Старые клетки могут повреждать соседние, могут выделять вещества, приводящие к воспалениям. Старые клетки могут становиться раковыми, и поэтому хорошо бы от них избавляться. Недавно были опубликованы результаты исследований по удалению с помощью специального лекарства старых клеток определённого типа у генно-модифицированных грызунов. И эти грызуны жили дольше. То есть вполне реально найти подход к стареющим клеткам.
Укорачивание теломер
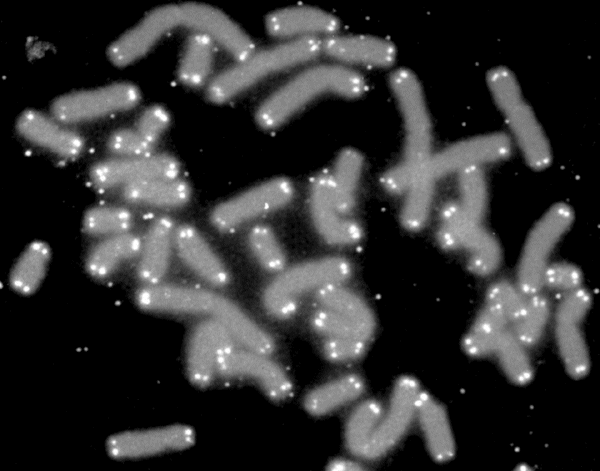
Человеческие хромосомы выделены серым цветом, теломеры — белым
Старение клеток связано с некоторыми процессами. Один из них — это укорачивание теломеры. Так устроена природа, что при каждом делении клетки молекула ДНК укорачивается. На концах хромосом имеются участки, называемые теломерами, которые и подвергаются укорачиванию, защищая тем самым остальную хромосому. Теломеры укорачиваются из поколения в поколение, и у старых клеток они становятся очень короткими. То есть клетки старого и молодого человека можно отличить по длине теломеры, с учётом некоторых вариаций в этих признаках.
Однако проблема укорачивания уже решена в наших стволовых клетках. В них есть фермент теломераза, который умеет достраивать теломеры. Поэтому про некоторые клетки говорят, что они бессмертны.
Ещё одна замечательная новость заключается в том, что мы можем удлинять теломеры с помощью генной терапии. Проводились опыты, в которых посредством специального вируса доставляли в грызунов теломеразу, и теломеры достраивались в клетках. Такие грызуны, как показывают эксперименты, живут дольше.

44-летняя Элизабет Пэрриш, руководитель американской научно-исследовательской компании BioViva, возможно, стала первым человеком, на котором была успешно испытана омолаживающая генная терапия
Подобные эксперименты вдохновили Элизабет Пэрриш попробовать на себе такую генную терапию. Понятно, что она делает это в рамках PR-кампании, потому что владеет крупной биотехнологической фирмой. В новостях проходила информация, что вроде как у неё удлинились теломеры. Но это не совсем научный эксперимент, нет контрольной группы, не с чем сравнивать. Хотя эта история многих вдохновляет, а опыты на грызунах говорят о том, что укорачивание теломер не является непреодолимой проблемой старения.
Накопление повреждений
Ещё одна вещь, которая происходит в клетках, — это накопление повреждений. Они бывают разные. Один из типов повреждений — это накопление в клетках всякого мусора. Например, плохо свёрнутых белков, как это бывает в случае с болезнью Альцгеймера. Или неправильно работающих органелл вроде испорченных митохондрий. При каждом делении клетки эти повреждения как бы разбавляются, и на каждую из двух получившихся клеток их приходится в два раза меньше. То есть при активном делении клетки могли бы омолаживаться.
Но у деления имеется и тёмная сторона — рак. Существуют генетические мутации, которые не разбавляются. Раковая клетка — это клетка, накопившая большое количество мутаций, которые могут приводить к неограниченному делению, отключению апоптоза. Сегодня появляется всё больше современных методов, направленных на борьбу с раком. Раньше он был совершенно неизлечимым заболеванием, теперь в ряде случаев он лечится.
Голодание
Один из самых красивых экспериментов по продлению жизни был связан с исследованием влияния частичного голодания. Эксперимент проводился на грызунах. Это график смертности:
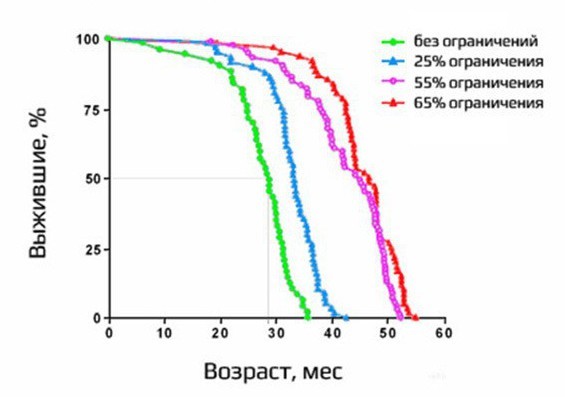
Зелёным цветом показаны те, кто ел от пуза, синие ели на 25% меньше, фиолетовые — на 55% меньше, а красные — на 65%. Как видите, максимальная продолжительность жизни увеличилась примерно в 1,5 раза. Зелёные погибали где-то в три года, а остальные жили существенно дольше. Когда все зелёные уже умерли, красные ещё живы. Впечатляющий результат. Оказалось, что механизм продления жизни через голодание актуален для очень разных организмов, хотя и не для всех. Есть такие, у которых частичное голодание сокращает продолжительность жизни. Но у многих видов это работает. Например, у круглых червей Caenorhabditis elegans, крыс, некоторых линий мышей, собак, есть противоречивые данные относительно макак. На людях очень сложно ставить такие эксперименты.
Когда выясняли, как частичное голодание продлевает жизнь червю, у него нашли гормоны, которые выделяются в ответ на потребление пищи. Эти гормоны воздействуют на рецептор DAF-2, расположенный на поверхности клетки, и это каким-то образом способствует старению. Если этот рецептор испортить, то такие черви живут примерно вдвое дольше.
Когда рецептор DAF-2 активируется, он запускает каскад клеточных процессов, приводящий к инактивации белка, который называется DAF-16. DAF-16 — это очень важный белок, регулирующий работу клетки следующим образом. Если еда в наличии и DAF-16 инактивирован, то клетка думает: «О, зашибись, еды полно, всё хорошо, можно расслабиться, мне ничего не угрожает, можно размножаться, делиться — всё прекрасно». Если этого сигнала нет, то есть DAF-2 испорчен, или если нет еды, то активируется DAF-16, клетка думает: «Какой ужас, я умираю, стресс, кошмар! Нужно спасать себя!» — и запускает кучу механизмов защиты: от мутаций, от окислительного стресса, теплового шока, всего подряд. То есть DAF-16 заставляет работать сотни других генов, защищающих клетку от различных проблем.
Оказалось, что у человека имеются белки, похожие на DAF-16 и DAF-2. Но в похожем на DAF-16 белке была обнаружена мутация. Есть люди с одним вариантом этого белка, и есть люди с другим вариантом. Владельцы первого варианта (FOXO3) намного чаще доживают до 90 лет и больше. То есть, изучая молекулярный механизм старения у червей, мы лучше понимаем, как устроены механизмы старения у человека.
Читайте статью далее.

Комментарии:
Авторизуйтесь, чтобы оставить отзыв